Catégorie : MedTech
3 minutes read
Renforcer la compétitivité MedTech par une intelligence de marché pilotée par l’IA

Dans le paysage concurrentiel de la technologie médicale (medtech), évaluer avec précision et faire croître la part de marché est un défi important auquel sont confrontés les cadres supérieurs et les responsables commerciaux. Souvent, ils reçoivent des demandes spécifiques concernant des produits pour des zones géographiques très précises, motivées par la conscience qu’une opportunité peut exister, mais sans disposer des données quantitatives nécessaires pour valider le potentiel du marché et justifier l’investissement. Même si leur organisation est active avec le produit et dans la région en question, il peut y avoir des problèmes liés à la dépendance aux données fournies par les équipes commerciales locales et les distributeurs. Ce post explore une stratégie pour relever ces défis grâce à une intelligence de marché activée par l’intelligence artificielle (IA).
Le besoin d’une intelligence de marché fiable
Une intelligence de marché précise est essentielle pour prendre des décisions éclairées concernant l’entrée sur le marché, l’expansion et l’investissement. Cependant, l’un des problèmes les plus courants est la dépendance à des sources de données limitées ou à des informations obsolètes.
Prenez contact avec nous
Veuillez fournir vos coordonnées et nous vous contacterons
S'abonner pour continuer à lire.
14 minutes read
Combler le fossé informatique dans la commercialisation des produits MedTech, Biotech et de l’industrie pharmaceutique
Introduction
Alors que les discussions technologiques dans les sciences de la vie, la MedTech, la Biotech et l’industrie pharmaceutique se concentrent principalement sur les essais cliniques, la conformité réglementaire ou la réutilisation des molécules, un angle essentiel reste peu exploré : le rôle de l’IT dans la commercialisation, les stratégies de mise sur le marché et l’accès aux marchés.
Ces enjeux sont pourtant critiques, car le succès commercial repose sur une intégration fluide entre l’exécution des ventes, la conformité réglementaire et la stratégie de marché — des éléments souvent cloisonnés dans les architectures informatiques traditionnelles. Des entreprises comme Vamstar peuvent jouer un rôle central pour surmonter ces barrières, en facilitant une commercialisation rationalisée et une entrée sur le marché plus efficace.

Register to continue reading.
6 minutes read
De la Théorie à l’Action : Naviguer entre l’ABV et l’ESG avec Vamstar
Dans le paysage en constante évolution des achats en santé et de la durabilité, les Achats Basés sur la Valeur (ABV) et les initiatives Environnement, Social et Gouvernance (ESG) se positionnent comme deux piliers interconnectés mais parfois ambigus de transformation.
L’ABV vise à transformer le paradigme des achats en santé en passant d’approches axées sur les coûts à des stratégies orientées sur la valeur, mettant l’accent sur les résultats pour les patients, l’efficacité et la qualité. L’ESG, quant à elle, intègre les considérations environnementales, sociales et de gouvernance dans les stratégies organisationnelles, garantissant une durabilité à long terme et des opérations éthiques.
Les organisations doivent de plus en plus équilibrer l’efficacité des coûts, la durabilité et les résultats centrés sur les patients. Cependant, cette tâche est rendue complexe par des cadres fragmentés et l’absence de normes standardisées, obligeant les organisations à interpréter et adapter des principes larges à leurs propres stratégies d’achat. Par exemple, il est essentiel de trouver un équilibre entre des économies de coûts à court terme et des impacts environnementaux à long terme, ou encore d’harmoniser des modèles de soins centrés sur le patient avec des exigences de durabilité financière.
Les capacités d’intelligence artificielle de Vamstar sont au cœur de ce défi, apportant clarté et direction face à cette complexité.
Comprendre l’Ambiguïté
Bien que l’ABV et l’ESG soient fondés sur des objectifs nobles — améliorer les résultats pour les patients et garantir une durabilité à long terme — ils comportent des ambiguïtés intrinsèques :
Définition évolutive de l’ABV :
L’ABV déplace l’objectif des prix vers la valeur, mais la notion même de « valeur » varie souvent entre les parties prenantes, qu’il s’agisse de prestataires de soins, de fournisseurs ou de patients. En l’absence de métriques standardisées, il devient difficile de définir le succès. Certains utilisent des indicateurs tels que les résultats des patients, les benchmarks d’efficacité des coûts ou les scores d’impact environnemental, mais ces indicateurs divergent largement. La mise en place de lignes directrices universelles ou de cadres collaboratifs pourrait faciliter une définition plus claire et actionnable de la valeur.
Déconnexion opérationnelle de l’ESG :
Malgré son importance croissante, l’ESG peine souvent à s’intégrer harmonieusement dans les stratégies d’achat. Les entreprises rencontrent des obstacles dans l’alignement de leurs processus opérationnels avec des objectifs de durabilité ambitieux, notamment en ce qui concerne le suivi des données et la démonstration d’impacts tangibles.
Cette double ambiguïté soulève des questions cruciales pour les organisations de santé : Comment mesurer le succès dans l’ABV ? Comment traduire les principes ESG en pratiques d’achat ? Et surtout, comment ces deux cadres peuvent-ils fonctionner ensemble ?
Vamstar : Éclairer le Chemin
Chez Vamstar, nous voyons dans l’ambiguïté de l’ABV et de l’ESG une opportunité d’innovation, plutôt qu’un obstacle. Nos solutions alimentées par l’IA, y compris ValueGPT, sont conçues pour rationaliser l’intersection de ces cadres, permettant aux organisations de santé de prendre des décisions basées sur les données, avec des résultats mesurables à la clé.
- Harmonisation des données : Grâce à une IA avancée, nous consolidons et classifions des ensembles de données variés, transformant des informations fragmentées en insights exploitables pour les stratégies ABV et ESG.
- Cartographie des preuves : Nos outils permettent de cartographier les preuves cliniques et de durabilité, offrant une vision claire de l’impact des décisions d’achat sur les résultats pour les patients et la conformité ESG.
- Suivi des politiques : Avec une analyse en temps réel des réglementations mondiales et régionales, nous aidons les organisations à aligner leurs stratégies d’achat sur les normes en constante évolution en matière de durabilité et de mesure de la valeur.
Vers un Cadre Unifié
La convergence entre l’ABV et l’ESG n’est pas seulement un défi, c’est une nécessité pour l’avenir des soins de santé. Chez Vamstar, nous prônons une approche intégrée où les décisions d’achat s’appuient sur des indicateurs à la fois de valeur et de durabilité.
Nos solutions permettent aux parties prenantes de :
- Définir des métriques claires : Établir des critères transparents et robustes pour évaluer la valeur et la durabilité dans les processus d’achat.
- Renforcer la collaboration : Encourager des partenariats solides entre fournisseurs, prestataires et décideurs politiques grâce à des données partagées et des objectifs communs.
- Accroître la responsabilité : S’assurer que chaque décision est alignée sur les résultats pour les patients et les objectifs de durabilité à long terme.
La Voie à Suivre
Les organisations de santé doivent évoluer de l’ambiguïté à l’action. L’avenir exige des solutions qui répondent aux complexités actuelles tout en anticipant les défis de demain. Chez Vamstar, nous nous engageons à transformer l’ABV et l’ESG en stratégies exploitables et impactantes, génératrices de changements mesurables.
Notre approche va au-delà de la simplification des processus : elle cherche à créer un changement de paradigme où la durabilité et la valeur sont intégrées de manière transparente. Grâce à des outils avancés comme ValueGPT, nous aidons les organisations à aligner leurs stratégies d’achat sur les normes mondiales tout en favorisant l’innovation et la responsabilité. Cela garantit non seulement la conformité, mais également des contributions significatives à l’écosystème des soins de santé.
Le parcours peut être complexe, mais avec les bons outils, des partenariats collaboratifs et une vision prospective, l’ambiguïté de l’ABV et de l’ESG devient une opportunité de leadership. Vamstar est là pour guider ce parcours, permettant aux organisations de santé d’atteindre une croissance durable et centrée sur la valeur, au bénéfice des patients, des parties prenantes et de la planète.
Découvrez ce que l’IA peut faire pour votre organisation.
Découvrez comment nous pouvons renforcer votre entreprise avec des solutions innovantes et stimuler votre croissance.
Contactez-nous.
Veuillez fournir vos coordonnées et nous vous contacterons.
9 minutes read
L’Évolution de l’IA dans les Dispositifs Médicaux : Défis Réglementaires et Perspectives d’Avenir
Introduction
L’intelligence artificielle (IA) et l’apprentissage automatique (ML) transforment le paysage des technologies médicales (MedTech), favorisant des avancées en matière de précision diagnostique, de traitement personnalisé et d’efficacité opérationnelle. Lors de la conférence Advamed MedTech, des leaders de l’industrie et des représentants réglementaires du Canada et des États-Unis ont exploré l’intégration de l’IA dans les dispositifs médicaux, mettant en lumière son potentiel transformateur et les cadres réglementaires nécessaires pour l’exploiter de manière responsable.
En août 2024, près de 1 000 dispositifs médicaux intégrant l’IA ou le ML ont reçu une approbation réglementaire. Ce jalon souligne la montée en puissance de l’IA tout en mettant en évidence la nécessité urgente de relever les défis uniques posés par des technologies adaptatives et auto-apprenantes. Garantir la sécurité, l’efficacité et une utilisation éthique dans un domaine en évolution rapide exige des stratégies réglementaires audacieuses et visionnaires.

La Révolution de l’IA dans les Dispositifs Médicaux
L’utilisation de l’IA dans les dispositifs médicaux remonte aux années 1990, avec des applications initiales dans l’imagerie basées sur des algorithmes fixes et statiques. Aujourd’hui, les modèles d’IA adaptatifs dominent, capables d’évoluer avec de nouvelles données et contextes. Ces capacités dynamiques ouvrent un potentiel révolutionnaire—soins personnalisés, diagnostics accélérés et systèmes de santé plus intelligents—mais introduisent également des complexités réglementaires bien au-delà de la supervision traditionnelle des dispositifs.
Pour suivre le rythme, l’industrie MedTech et les régulateurs repensent les cadres qui reposaient historiquement sur des définitions statiques des produits et des approbations préalables à la mise sur le marché. L’accent est de plus en plus mis sur la surveillance continue, la supervision adaptative et la collaboration intersectorielle.
Diriger la mise en place des mesures réglementaires : Santé Canada et la FDA
Les agences réglementaires intensifient leurs efforts pour répondre aux exigences de l’innovation guidée par l’IA :
- Division de la Santé Numérique de Santé Canada : Créée en 2018, cette équipe supervise les dispositifs médicaux à haut risque utilisant l’IA, en se concentrant sur la cybersécurité, les logiciels et les technologies d’apprentissage adaptatif. Elle joue un rôle clé dans l’établissement de normes de performance spécifiques au Canada et de directives pour le cycle de vie.
- Centre d’Excellence en Santé Numérique de la FDA : Pionnière dans les cadres pour l’IA/ML en santé, la FDA adapte sa philosophie réglementaire pour équilibrer innovation rapide et normes de sécurité rigoureuses.
Les principaux obstacles réglementaires
1. Dégradation des Performances
Les modèles d’IA adaptatifs peuvent dériver, c’est-à-dire voir leurs performances diminuer avec le temps en raison de changements dans les environnements de données. Les régulateurs poussent à mettre en place des cadres de surveillance en temps réel pour garantir la sécurité et l’efficacité tout au long du cycle de vie d’un dispositif.
2. Transparence et Explicabilité
La complexité des modèles d’IA crée souvent un “effet de boîte noire”, rendant difficile la compréhension des décisions. Les régulateurs s’efforcent d’améliorer la transparence pour permettre aux parties prenantes de faire confiance aux systèmes d’IA sans nécessairement en comprendre toute la complexité.
3. Surveillance Post-Marché
La capacité de l’IA à évoluer après son déploiement nécessite un déplacement de l’accent réglementaire des évaluations préalables au marché vers une surveillance continue et robuste des performances. Les agences expérimentent des modèles de supervision adaptatifs pour s’aligner sur le développement continu de l’IA.
4. Évolution des Cadres Réglementaires
Les structures réglementaires établies depuis des décennies, conçues pour des dispositifs statiques, sont mal adaptées à la nature dynamique de l’IA. Des agences comme la FDA et Santé Canada redéfinissent ce qui constitue un dispositif médical, établissant des processus d’approbation itératifs et explorant des voies pour des mises à jour rapides.
5. Défis de Déploiement Multi-Site
Les modèles d’IA entraînés dans un environnement peuvent sous-performer dans d’autres contextes. Les régulateurs et les fabricants collaborent sur des protocoles pour une adaptation et une validation locales afin de garantir des performances cohérentes dans divers contextes cliniques.
6. Pressions sur la Main-d’Œuvre en Santé
L’IA est de plus en plus perçue comme une solution pour atténuer les pénuries de main-d’œuvre. Les régulateurs équilibrent la nécessité d’accélérer le déploiement de l’IA avec des garanties pour assurer une supervision humaine, une intégration éthique et une formation adéquate des cliniciens.
7. Silos de Données
Les ensembles de données fragmentés du secteur de la santé freinent le développement des modèles d’IA. Les agences réglementaires travaillent à briser ces silos grâce à des cadres pour l’apprentissage fédéré, la génération de données synthétiques et le partage de données sécurisé et conforme aux règles de confidentialité.
Progrès et Innovations Réglementaires
Initiatives Stratégiques de Santé Canada
- Orientation sur l’Apprentissage Machine : Un document d’orientation à venir définira des normes claires pour le cycle de vie des dispositifs d’IA, axées sur l’adaptabilité et l’amélioration continue.
- Conditions de Licence : Des conditions sur mesure garantissent que les dispositifs répondent aux normes de performance même après leur déploiement.
- Engagement Collaboratif avec les Parties Prenantes : Les partenariats entre industrie, universités et institutions de santé orientent les priorités réglementaires du Canada.
- Comité Consultatif Scientifique : Ce groupe d’experts guide les stratégies de santé numérique en mettant l’accent sur le développement de politiques liées à l’IA.
- Plans de Contrôle des Changements Préétablis (PCP) : Ces plans permettent aux fabricants de mettre en œuvre des mises à jour pré-approuvées, réduisant ainsi les goulots d’étranglement réglementaires.
Cadre Visionnaire de la FDA
- Développement de Normes : Viser des benchmarks universels pour les technologies d’IA.
- Protocoles de Gestion des Risques : Des systèmes complets d’assurance qualité surveillent les risques liés au cycle de vie de l’IA et atténuent les menaces émergentes.
- Évaluation Nuancée : En différenciant l’IA prédictive et générative, la FDA adapte ses examens réglementaires aux caractéristiques spécifiques de chaque technologie.
- Éducation Proactive : Des efforts de sensibilisation équipent les parties prenantes—des législateurs aux cliniciens—des connaissances nécessaires pour naviguer dans l’intégration de l’IA.
Harmonisation Mondiale
Des initiatives telles que le Forum International des Régulateurs de Dispositifs Médicaux (IMDRF) et des publications conjointes de Santé Canada, de la FDA et de la MHRA au Royaume-Uni visent à standardiser les approches réglementaires mondiales, favorisant ainsi la cohérence entre les juridictions.
Les concepts émergents qui façonnent la réglementation
- Transparence vs Explicabilité : Les régulateurs privilégient une communication transparente des capacités de l’IA tout en reconnaissant que l’explicabilité totale peut ne pas être réalisable pour tous les modèles.
- Collaboration Humain-IA : Les cadres considèrent de plus en plus l’IA comme un outil d’augmentation, mettant l’accent sur son intégration dans les flux de travail des cliniciens plutôt que sur des prises de décision autonomes.
- Gestion du Cycle de Vie : Une supervision adaptative garantit la sécurité tout au long du cycle de vie d’un dispositif d’IA, du développement à la mise hors service.
- Atténuation des Biais : L’IA doit démontrer son équité dans les résultats pour diverses populations, ce qui pousse à des analyses de sous-groupes plus strictes et à des protocoles d’identification des biais.
- Évolution Bénéfices-Risques : Les évaluations réglementaires prennent désormais en compte les bénéfices systémiques à long terme, même dans des cas où les données statistiques traditionnelles peuvent être limitées.
Orientations futures
- Redéfinir les Dispositifs Médicaux à l’Ère de l’IA : L’IA brouille la frontière entre logiciel et matériel, incitant les régulateurs à repenser les classifications et catégories d’approbation.
- Accélérer les Délais de Réglementation : Des soumissions progressives et des approbations par phases sont explorées pour suivre le rythme des avancées de l’IA tout en maintenant des normes de sécurité strictes.
- Mettre l’Accent sur les Populations Défavorisées : Des incitations ciblées encouragent le développement de solutions d’IA pour les soins pédiatriques et les communautés sous-représentées, comblant ainsi les écarts d’équité dans les soins de santé.
- Standardiser la Transparence : Des cadres comme les cartes de modèles et de données deviendront des outils essentiels pour communiquer les limitations et capacités de l’IA.
- Intégration Systémique de l’IA : Le potentiel de l’IA dépasse les dispositifs pour s’attaquer aux pénuries de main-d’œuvre et aux défis de coûts. Les régulateurs explorent des cadres qui tiennent compte de l’impact systémique plus large de l’IA.
Conclusion
L’intégration de l’IA dans les dispositifs médicaux représente l’un des changements de paradigme les plus significatifs de la médecine moderne. Bien que les avantages—précision accrue, soins personnalisés et efficacité opérationnelle—soient immenses, ces avancées exigent des cadres réglementaires aussi dynamiques et adaptatifs que les technologies elles-mêmes.
En adoptant une gestion axée sur le cycle de vie, en favorisant la transparence et en priorisant la collaboration entre les parties prenantes, les régulateurs peuvent équilibrer innovation et sécurité.
Alors que l’IA redéfinit le paysage MedTech, son intégration responsable façonnera la prochaine ère des soins de santé, offrant des solutions transformatrices aux défis mondiaux. L’avenir est ici, et il est adaptatif, intelligent et profondément collaboratif.
Découvrez nos solutions
Explorez les façons dont nous pouvons renforcer votre entreprise en utilisant les solutions d’IA Agentic et stimuler la croissance.
Autres articles
7 minutes read
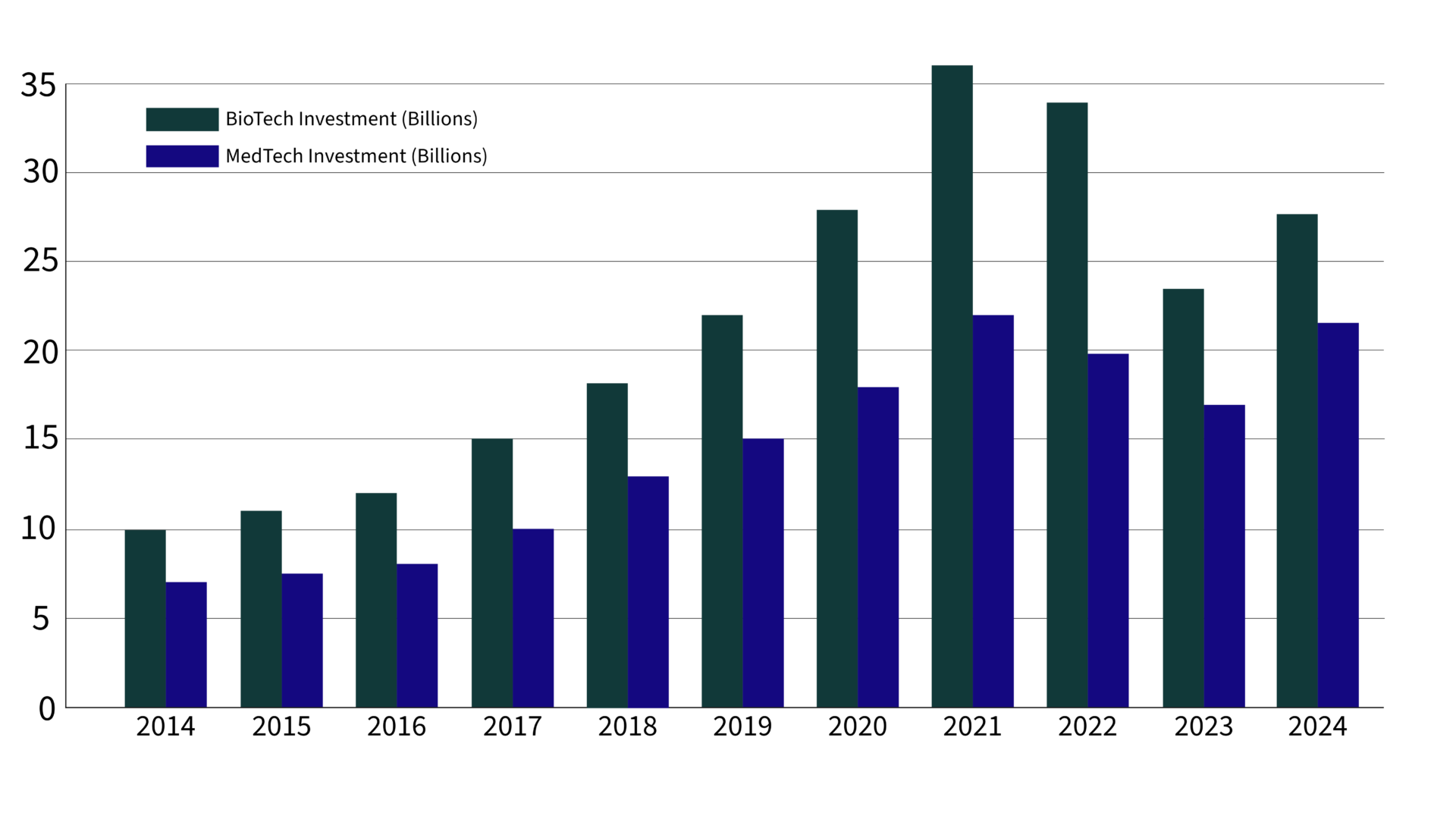
La reprise des investissements en biopharma et MedTech en 2024

Après deux années d’investissements prudents, le capital-risque effectue un puissant retour en biopharma et MedTech, signalant un regain de confiance dans le potentiel d’innovation en santé.
Selon les données récentes du rapport du troisième trimestre 2024 de JPMorgan, les investissements en capital-risque dans la biopharma devraient atteindre 27,7 milliards de dollars cette année, tandis que les investissements en MedTech devraient augmenter de 30 % par rapport à ceux de 2023, pour atteindre un impressionnant 21,5 milliards de dollars.
Cet afflux reflète des changements stratégiques vers des investissements plus importants et moins nombreux, avec un accent renouvelé sur les technologies à fort impact et évolutives qui promettent de remodeler les soins aux patients.
Register to continue reading.